
Запам’ятайте абревіатуру CRISPR уже сьогодні, бо завтра вона, найімовірніше, змінить ваше майбутнє. Адже саме таку назву носить одна з найбільш перспективних технологій редагування генів. Учені лише почали відкривати її можливості, але і наявні досягнення вражають.
Назва технології CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) вимовляється як «кріспер». Вона є біологічною системою для зміни ДНК і базується на імунній системі бактерій. CRISPR відкрила у 2012 році молекулярний біолог, професор Дженніфер Дудна. Її команда вчених в Університеті Берклі в Каліфорнії вивчала, як бактерії захищаються від вірусної інфекції.
Зараз професор Дудна та її колега Еммануель Шарпентьє є одними із найвпливовіших учених світу. Природний механізм, який вони виявили в ході своїх досліджень, може бути використаний біологами для того, щоб вносити точкові зміни в будь-яку ДНК. «Відтоді як ми опублікували своє дослідження чотири роки тому, багато світових лабораторій стали застосовувати цю технологію на тваринах, рослинах, людях, грибках, інших бактеріях – іншими словами, практично на кожному досліджуваному організмі», – розповіла професор в інтерв’ю BBC.
Суть CRISPR полягає в тому, що коли бактерію атакує вірус, вона виробляє генетичний матеріал, який відповідає генетичній послідовності нападника. Цей матеріал у поєднанні з ключовим білком Cas9 може прикріпитися до ДНК вірусу, зламати його генетичний код і нейтралізувати вірус. Це схоже на те, як працюють антивіруси на комп’ютерах: у них є база даних фрагментів вірусів, і з нею вони виявляють шкідників.
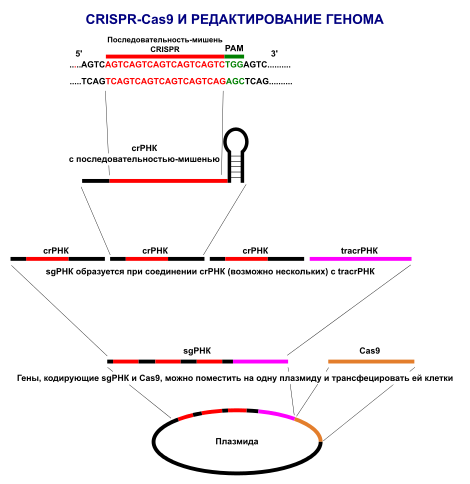
Тепер учені можуть застосовувати цю ж схему, щоб вставляти в ДНК нові елементи, видаляти або виправляти її ділянки. Цей процес настільки точний, що вчені можуть перебрати мільярди хімічних комбінацій – складових ДНК клітини, – щоб внести в генетичний код якусь конкретну ключову зміну.
Важливо і те, що це простий і недорогий метод. Тому він прискорить усі види досліджень – від створення генетично модифікованих моделей людських хвороб у тварин до пошуку мутацій ДНК, які провокують виникнення захворювань або, навпаки, захищають від них.
Коли чекати в медицині
Коли і як ми відчуємо на собі наслідки лікування із застосуванням CRISPR? Технології лише кілька років, тому її випробовування на пацієнтах ще не почалися. Проте деякі експерименти вже знаходяться на стадії планування.
Бостонська біотехнічна фірма Editas Medicine планує запустити клінічні випробування перших ліків, що модифікують гени, до 2017 року. Розроблюваним препаратом можна буде лікувати сліпоту Лебера (LCA10) – рідкісне захворювання сітківки ока, яке призводить до сліпоти, оскільки в результаті мутації генів відбувається поступова втрата розташованих в оці фоторецепторів.
У сфері біотехнологій існує відразу кілька недавно створених фірм, які сподіваються впровадити застосування технології CRISPR у лікарнях. Вони припускають, що «кріспери» можна використати для посилення функцій Т-клітин організму. Це поліпшить здатність нашої імунної системи розпізнавати ракові клітини і боротися з ними. Ще одна потенційна галузь застосування технології – лікування захворювань крові та імунної системи.
Патенти на перешкоді
Райдужне майбутнє CRISPR може затьмаритися боротьбою за патент на технологію. З одного боку, на нього претендує команда професора Дудни, з іншого – група вчених з Бостона. Це не зупинить дослідження, але може їх загальмувати та вплинути на те, хто отримає фінансову вигоду від нової технології.
Редагування генів на практиці
Дві попередні технології генної інженерії вже застосовуються на практиці. Одну з них – TALENs – торік використали в лондонській лікарні Грейт-Ормонд-стріт для успішного лікування раку. У пацієнтки Лайли Річардс була агресивна форма лейкемії, і їй не допомагало традиційне лікування. На сьогоднішній день Річардс залишається першою та єдиною людиною, чиє життя врятували редагуванням геному.
Перші у світі випробування генної інженерії відбувалися в Каліфорнії з використанням іншої технології – ZFNs. Ексклюзивною ліцензією на це рішення володіє каліфорнійська фірма Sangamo Biosciences.
За технологією ZFNs імунні клітини вилучили з крові близько 80 пацієнтів з ВІЛ. Потім учені видалили з цих клітин ген під назвою CCR5, який ВІЛ-інфекція використовує для доступу до клітин. Це лікування було засновано на рідкісній природній генній мутації, яка дає людям природний імунітет до захворювання.
Одним із волонтерів у тому дослідженні був Метт Чаппелль, який прожив з вірусом більшу частину дорослого життя. З того часу як ген його імунних клітин відредагували, Чаппелль уже два роки не користується антиретровірусними препаратами.
Ці дослідження були невеликими й експериментальними, тому до їхніх результатів потрібно ставитися обережно. Проте отриманий ефект виглядає багатообіцяючим.
Перспективи генної інженерії
Найбільш спірне питання в редагуванні генома – внесення змін до статевої клітини людини. Гени з них передаються з покоління в покоління. Теоретично можна було б змінювати ДНК ембріонів, які несуть у собі ген хвороби Хантінгтона або муковісцидозу. Однак у такому випадку можна говорити і про проведення інших генетичних поліпшень, що фактично може привести до генетичного проектування немовлят.
Учені не пропонують, принаймні зараз, виготовляти генетично модифікованих немовлят. Однак кілька груп китайських учених уже провели деякі базові дослідження в цій сфері, а Великобританія стала першою країною, яка формально дозволила генну модифікацію людських ембріонів – виключно в наукових цілях. Дослідження будуть проходити в лондонському інституті Френсіса Кріка, який відкриється через кілька місяців. Там буде знаходитися найбільша біомедична лабораторія в Європі і центр генної інженерії.
Команда під керівництвом Кеті Ніакан, яка недавно увійшла в список зі 100 найвпливовіших людей світу за версією журналу Time, буде використовувати CRISPR для редагування основних генів ембріона, щоб виявити генетичні помилки, які призводять до повторюваних викиднів. У рамках дослідження ембріонам дадуть розвиватися лише кілька днів.
«Я сподіваюся на те, що це дозволить нам більш точно розібратися в механізмах раннього розвитку людини. Я думаю, що це також допоможе з’ясувати, як ми можемо покращити технологію екстракорпорального запліднення, і зрозуміти, які ембріони з більшою ймовірністю продовжуватимуть розвиватися і приведуть до народження здорових дітей», – каже Ніакан.
Однак ці дослідження викликають етичні питання у Марсі Дарновскі з Центру генетики і суспільства в Сан-Франциско. На її думку, генетична модифікація людських ембріонів при недостатньому контролі призведе до того, що рано чи пізно в одній з лабораторій буде створено перше генетично модифіковане немовля. «Знайдуться багаті батьки, які захочуть придбати для свого потомства останній «апгрейд». Цілком можливо, що люди розділяться на тих, хто може дозволити собі поліпшити своє потомство, і тих, кому це не по кишені або хто не захоче цього робити. А це призведе до ще більшої нерівності, ніж та, з якою ми вже маємо справу», – вважає Дарновскі.
За словами Дудни, незважаючи на те що дуже важливо регулювати використання «крісперів», разом з тим необхідно і дійти згоди щодо подальших дій. «Я не хочу давати нездійсненних обіцянок, але мені здається, що це допоможе покласти край хворобам – і ми повинні дати шанс ученим і лікарям втілити це в життя», – говорить професор.
За матеріалами: BBC


